
产品中心
PRODUCT

电 话:0898-08980898
手 机:13877778888
联系人:xxx
E_mail:admin@Your website.com
地 址:广东省清远市
解析:基因治疗作用机制、技术路径与行业发展趋势
比如,眼科适应症在基因治疗中具有以下优势:1)相对的免疫豁免■◆;2)两只眼睛★◆★■★■,其中一只可以做control◆★◆■★◆;3)相对安全;4)AAV的用量相对较少;5)20%的遗传疾病都发生在眼睛上■■★★◆■,可选择疾病种类较多。
从源头而言,大多数疾病的发生都是基因层面出了问题,根据基因变异类型的不同,大致可分为两类:1)基因突变导致其指导合成的蛋白质功能异常,表现为蛋白质没有功能■★■★、功能变弱或过强,甚至产生有害蛋白;2)基因表达强度异常,表现为不该表达的基因表达、应该表达的基因不表达、基因表达的强度过强或过弱等★■◆■■◆。
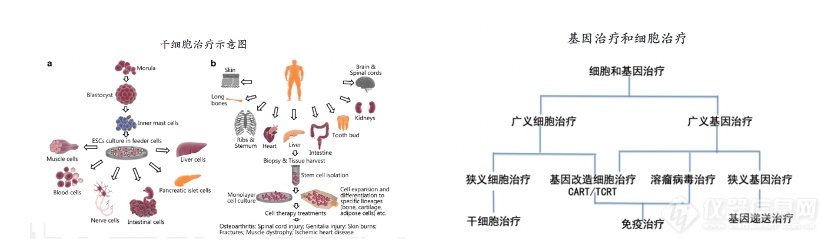
狭义的基因治疗只是基因递送■■★◆■,不包括CAR-T/TCR-T和溶瘤病毒治疗,广义的基因治疗则包含了基因递送和 CAR-T/TCR-T、溶瘤病毒。

脊髓性肌萎缩症(SMA)是一种非常罕见的神经肌肉遗传疾病,由5号染色体SMN1基因的遗传突变引起★■◆。该基因编码的运动神经元存活(SMN)蛋白是维持人体运动神经元细胞正常功能的重要物质,突变将造成正常蛋白数量减少,导致运动神经元细胞死亡,引起肌肉力量减弱甚至完全丧失;该疾病非常罕见,全世界仅有约10000人患病。婴儿期起病的亚型(SMA 1)是该病最常见、最严重的亚型,症状通常出现于6个月时◆★■,由于严重的呼吸■★★◆◆◆、吞咽困难■◆★★◆★,患儿往往难以活过2岁。
血友病A,即凝血因子VIII缺乏症;血友病B◆■■★★★,即凝血因子IX缺乏症;血友病C,即凝血因子XI缺乏症。发病率以血友病A最多占85%,血友病B占15%,血友病C较少见。根据出血轻重与血浆中凝血因子活性的水平■■◆★■,将本病分为4型■★:重型、中间型、轻型★◆★、亚临床型■◆■■★。目前■★,重型 血友病A的治疗标准是每周2-3次静脉输注凝血因子VIII(重型血友病A约占该患病人群的50%)。值得指出的是■★,A型血友病涉及的基因序列较大◆◆◆■■,其基因治疗产品的研发难度高于B型血友病。
根据基因变异类型的不同,导致疾病发生的基因异常大致可分为两类■■★:1)基因突变导致基因指导合成的蛋白质功能异常,表现为蛋白质没有功能■■、功能变弱或功能过强★◆■,甚至产生有害蛋白■◆◆■;2)基因表达强度异常,表现为不该表达的基因表达■★◆、应该表达的基因不表达、基因表达的强度过高或过低等。
美国:诺华表示一直与医保支付方沟通,迄今为止,覆盖了90%的商业医保的患者和30% Medicaid计划 的患者( Medicaid/白卡,是美国联邦和州政府共同拨款的联合医疗补助计划);日本:Zolgensma此前在美国定价超过2亿日元◆★◆★■,被称为“全球最贵的药物★★”,在日本地区定价为1亿6700万日元(约合1110万人民币),是日本医保目录中价格最高的药品★◆★◆。
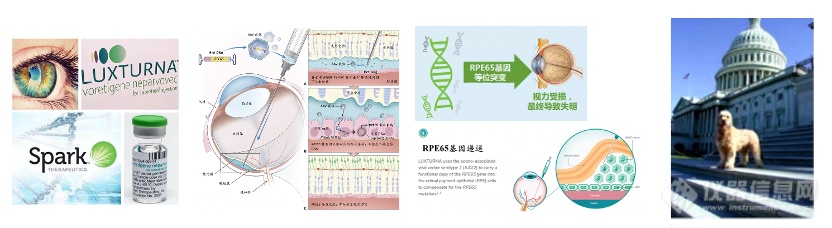
已有研究发现了19个与LCA相关的致病基因,其中由RPE65基因突变导致的LCA称为LCA II型,约占LCA的16%。RPE65基因突变导致RPE65蛋白失去异构酶活性◆★◆■■,从而造成光感受器细胞不能对光发生反应,最终导致视力丧失。Luxturna采用了AAV2载体,递送RPE65基因,直接注射到视网膜色素上皮(RPE)细胞中■■■。在患者细胞表达RPE65蛋白后★◆■◆■■,细胞内的视黄醛循环得以继续,从而渐渐获得感光的视觉能力。
病毒载体基因治疗产品:对病毒进行改造(比如删去复制基因)去除其引发传染性疾病的能力,再将目的基因通过质粒共培养的方式装载到病毒颗粒中,病毒感染细胞进入细胞核后释放目的基因并转录表达◆■■★■★。比如于 2019年5月由FDA批准上市的诺华公司的Zolgensma,即为搭载SMN1基因的改造AAV9病毒,递送到神经系统后可表达出SMN蛋白从而可以治疗脊髓性肌肉萎缩症(SMA),曾经为史上最昂贵的药,售价为210万美元。(Bluebird的Zynteglo在2022年8月17号于FDA获批◆◆■,高达280万美元/1900万人民币,刷新了世界最昂贵药物的记录。但是在短短一个月后◆★■■,2022年9月16日Bluebird又再一次官方宣布FDA已加速批准基因治疗药物Skysona上市,用于减缓4-17岁早期活动性脑肾上腺脑白质营养不良(CALD)男孩神经功能障碍的进展,Skysona在美国的定价为300万美元■◆■★★★,这意味着全球最贵药物的记录在短短30天内再次被打破★■◆■,最新的天价药王诞生)■★。
Leber氏先天性黑蒙症(LCA)是一组遗传性视网膜变性疾病,由至少18个不同基因的突变引起★★■★★◆。它是儿童遗传性失明的最常见原因■■■★,10万名儿童中会有3人受到影响■■■◆。该疾病一般出现在儿童时期,并导致严重的视力丧失和潜在的失明。LCA最常见形式为LCA10★★,约占所有患者的20%-30%,目前没有可用的治疗选择。全球首个上市的眼科基因疗法Luxturna的方法在LCA10患者中是不可能的,因为导致该病的突变基因太大,无法放入用作运送工具的灭活病毒中★★■◆。目前正在临床中的做法是采用Crispr基因编辑策略。
将核酸序列递送至靶细胞中,即:递送问题。如何更加有效的将核酸序列递送至靶细胞,取决于载体的递送效率◆■◆■、载体的制备质量、对靶细胞的转染效率。这是决定药物剂量的第二个因素。

AAV8和AAV9衣壳蛋白能够靶向身体中的多种肌肉类型,这让AAV介导的基因疗法能够用于治疗多种肌肉疾病,其中包括杜氏肌营养不良症(DMD)■★◆■■★。值得一提的是,肌肉可以作为生成治疗性分子的“体内工厂”■◆■★★,因此靶向肌肉组织的基因疗法可以用于治疗非肌肉疾病。AAV递送的另一个重要方向是中枢神经系统(CNS),包括眼睛和大脑。眼睛是一个相对隔离的环境,直接进行眼内注射递 送AAV基因疗法能够达到治疗多种遗传性眼病的效果。Spark公司开发的获批疗法Luxturna就是治疗由于RPE65基因突变而导致失明的患者■★。
细胞基因治疗产品:从患者提取细胞后,经过基因改造(通常使用病毒载体)后返输回患者体内。比如于2017年获批的Kymriah,即是将患者的T细胞取出◆■◆,通过慢病毒将CD19抗体基因转染到T细胞中,该基因可在T细胞表面表达出CD19抗体■■,经筛选增殖后回输患者体内◆■■■,实现对B细胞淋巴瘤的杀伤◆◆◆★。
非病毒载体■◆◆◆■■:主要有的DNA、质粒、脂质体、微球粒★◆★,以及内源性的物质如外泌体、红细胞及囊泡、血小板。该类载体具有低免疫原性、可以多次给药等优点■★,但目前工程化◆★■、量产化的CMC◆◆★■★、纯化等工艺问题还存在不少瓶颈;
从Spark Therapeutics公司公布的III期临床试验数据来看,在接受治疗的29名患者中有27名患者的规力得到了显著改善,有效率高达93.1%,随访1年后,仍有21名患者保持良好的治疗效果。
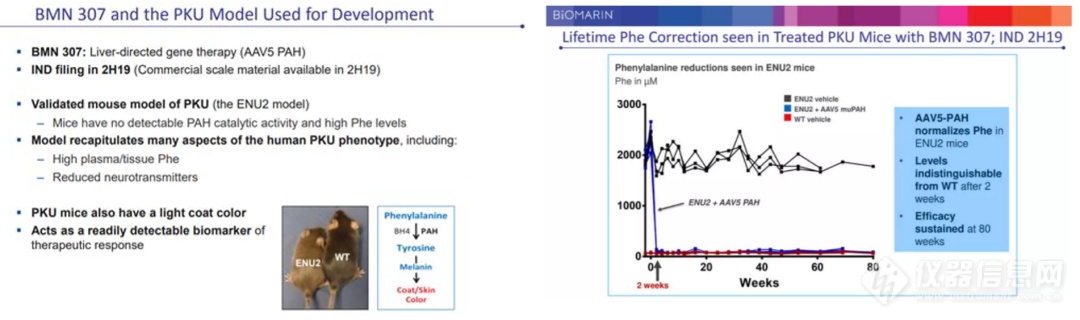
2021年9月6日,BioMarin公司宣布FDA暂停了该公司治疗苯丙酮尿症(PKU)基因疗法BMN307的 I/II期临床研究。BMN307是一种以AAV5为载体的基因疗法,其搭载的目的基因可表达功能正常的苯丙氨酸羟化酶(PAH)■■,通过将PAH基因递送到肝细胞■◆■■,肝细胞可作为产生功能正常的PHA的◆◆“工厂”◆★★★◆,最终使PKU患者的血液苯丙氨酸(Phe)浓度正常化。
图片来源:Proceedings Biological Sciences,华金证券研究所
此临床试验暂停是基于一项临床前非GLP药理学研究的新数据★■★◆,该研究旨在了解BMN307药效活性在带有两个种突变(一种突变是敲除了PAH基因■■,另一种突变则可以使小鼠出现免疫缺陷)的小鼠中的持久性,这两个突变 可能使小鼠易患恶性肿瘤◆★★★。上述临床前动物实验采用了高剂量的给药(2e14 vg/kg),较高剂量的AAV给药确 实存在较高的毒性风险◆★。但公司进行的 I/II期临床试验采用的剂量为较低剂量(2e13 vg/kg、6e13 vg/kg)。由于AAV整合导致的癌症尚未在大型动物或人类中观察到,因此临床前啮齿动物研究的临床意义尚未确定。
针对翻译后蛋白合成过程进行优化■◆■,特异性启动子,蛋白折叠★◆■★、适量表达等多种因素★◆;启动子效果不能太强、也不能太弱,根据具体的治疗蛋白需求,设计恰到平衡的启动子是关键之一;

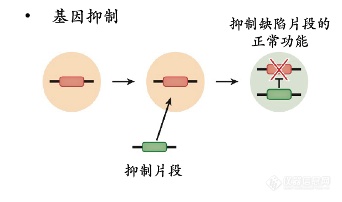
基因抑制:使无法正常工作的致病基因减弱或沉默,实现方式有些类似于基因编辑,难度较大◆★★■。相比之下,小核酸干扰机制(RNAi)反而更适用于该策略■◆。
理想的基因治疗载体特性:1)具有靶向特异性■◆◆■◆,能靶向特定的器官、组织★◆★■★■、细胞,且可以高效转导★■■★、长期稳定表达转基因;2)有足够的空间来容纳和递送大片段的治疗基因■★★■■■;3)具有高转导效率,能感染分裂和非分裂的细胞◆★★◆■★;4)缺乏自动复制载体自身的能力■■★★◆,具有较低的免疫原性的或致病性,不会引起炎症■■★★◆;5)高度稳定、易制备、可浓缩和纯化,具备大规模生产的能力。
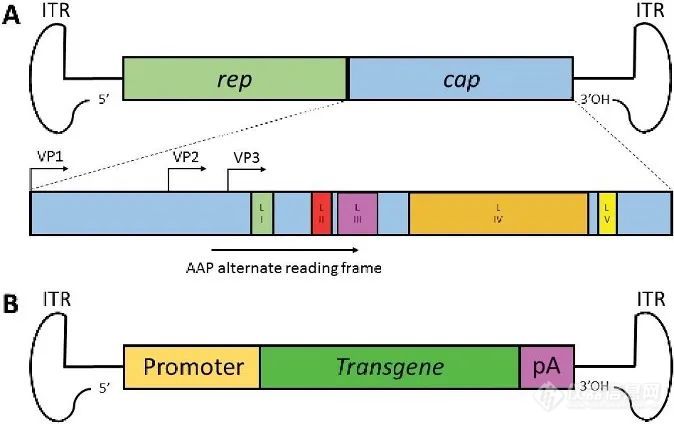
腺相关病毒(adeno-associatedvirus,AAV)是一种大小约为26nm,只包含一条单链线状DNA基因和蛋白质衣壳的无包膜病毒■◆◆◆■★,最早在恒河猴肾细胞的培养物中首次发现;
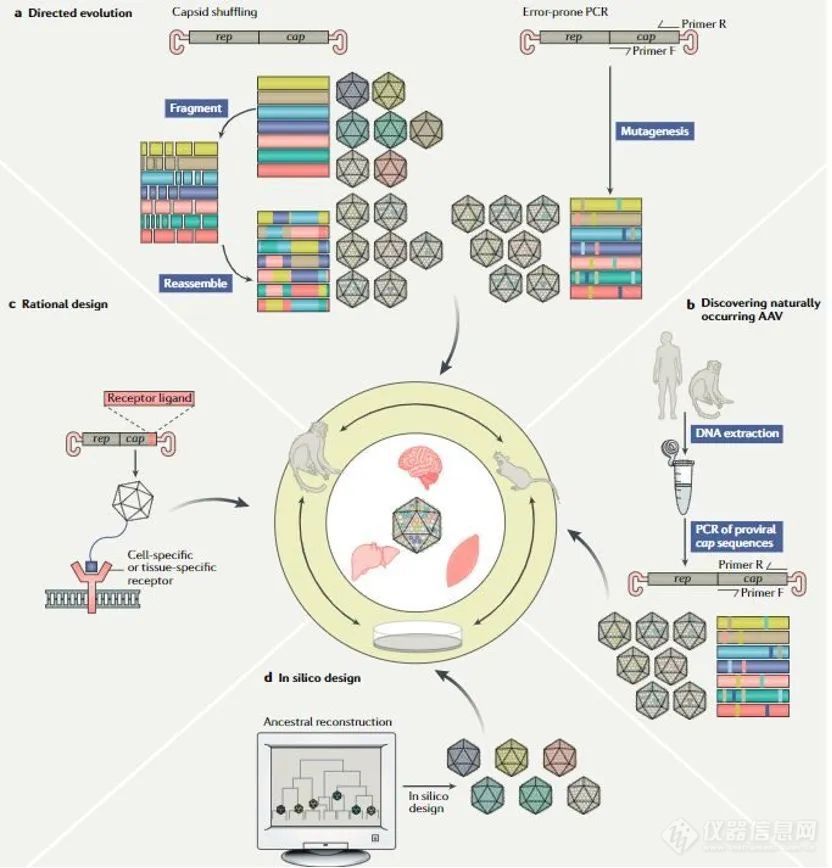
提高AAV载体对于组织的特异性:几乎所有天然AAV衣壳蛋白能够在肝脏中引发有效的转基因表达◆★;AAV8和AAV9衣壳蛋白能够靶向身体中的多种肌肉类型;AAV9和AAVrh.10能够穿越血脑屏障。通过载体设计优化得到更多组织特异性更佳的AAV载体也是当前的方向。

上述两点使得治疗效果得以改善,同时可以降低治疗剂量,这对于基因治疗是关键制约因素之一。序列设计往往在过分强调载体优化的大背景下被忽略。从投资的角度而言◆★★◆,或许是一个差异化的机会。
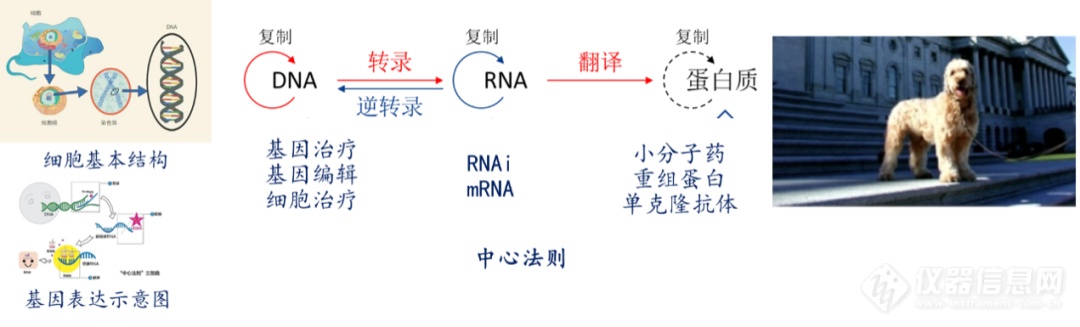
根据中心法则,每一个生理过程都可以理解为特定的基因在特定的时间和空间里表达的结果,平衡被打破就会诱发疾病。几乎所有疾病的发生理论上都可以在DNA水平进行解释,这也是基因治疗的理论基础★★■。
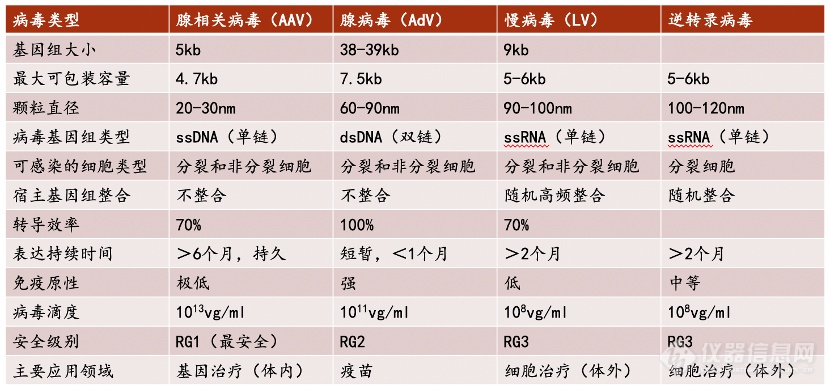
1.病毒载体向非病毒载体的过渡◆■◆■★,如LNP,特别是人体内源性物质如外泌体、红细胞及囊泡★◆■■■■、血小板★◆;未来的大方向是低免疫原性◆◆★■★◆、可重复给药★■■◆★;
4◆★◆★★.CMC的规范化■★◆◆■★,NMPA/FDA审评标准,符合药物监管部门要求的质量控制系统;
3.序列设计的优化,表达与分泌的优化,药效的持续性(Biomarin,血友病);
DNA、RNA、蛋白质三个层面◆◆★,传统的小分子(如靶向药)、大分子(单抗,重组蛋白等)都是针对蛋白质层面的治疗策略,基因治疗是针对源头(DNA)的治疗策略,RNAi◆★◆■★■、mRNA是针对中间过程的治疗策略◆★■★◆。
2019年,FDA批准了诺华公司研发的AAV基因疗法Zolgensma,用于治疗2岁以下患有存活运动神经元1(SMN1)等位突变导致的脊髓性肌萎缩症(SMA)的儿童患者。Zolgensma采用了AAV9载体,能够透过血脑屏障,将SMN1基因递送到中枢神经系统从而发挥功能。
罗氏在2019年12月完成了48亿美元收购企业Spark Therapeutics的交易,包括已上市的罕见眼科疾病药物Luxturna和处于III期阶段的B型血友病疗法SPK-9001等。Luxturna每只眼睛定价42■◆.5万美元,双眼治疗价格在85万美元(眼科基因疗法的独特优势是■★:可以选择单眼治疗,也可选择双眼治疗)。其2018年共销售了75份,销售额达2700万美元。
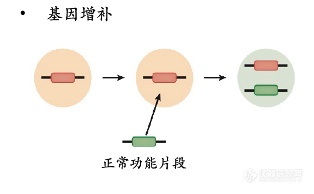
导入的基因可以是与缺陷基因对应、在体内表达具有特异功能的同源基因,也可以是与缺陷基因无关的治疗基因。按照导入基因的策略◆★◆★★■,可分为三种类型:基因增补、基因抑制、基因编辑。
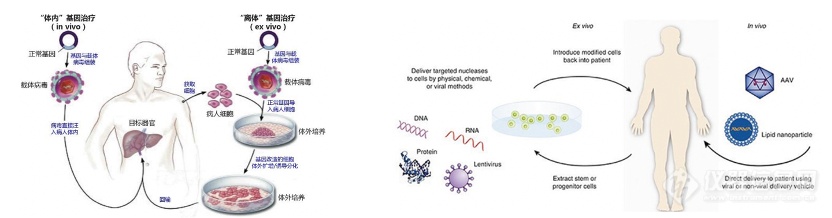
“体内”基因治疗的操作流程相对简单,大致可分为3个步骤:1)利用基因工程的方法将正常基因插入到 病毒载体的DNA上■◆◆★■★;2)将重组后的病毒DNA体外包装产生具有感染能力的完整工程病毒;3)把重组后的病毒直接注入病人体内,病毒感染病变细胞并将正常基因带到靶细胞中,实现疾病的治疗。
当前大部分CGT治疗项目为病毒载体,使用非病毒载体的项目大约仅占项目总数的28.3%■■。
基因增补:将外源基因导入表达靶细胞(如肝脏细胞)■■■■★■,其表达产物能修饰缺陷细胞的功能,是目前已上市和在研基因疗法的最主要策略。简而言之,就是“缺啥补啥”◆■◆★■★,也是迄今理论基础最清晰、最容易成药的策略。
5★★◆★.从罕见病向常见病的拓展,譬如眼内表达抗VEGF的蛋白(脉络膜上腔注射);
基因编辑治疗:能够精确对生物体基因组的特定目标基因进行修饰,从而达到破坏有害基因或者修复变异基因的目的。基因编辑技术包括同源重组◆■■、锌指核酸酶(ZFNs)技术■◆★、转录激活样效应因子核酸酶(TALEN)技术和获得2020年诺贝尔化学奖的CRISPR/Cas9技术。目前暂无药物上市。
最高约1000万元/项!山西省启动征集2024年度国家自然科学基金区域创新发展联合基金(山西)指南建议
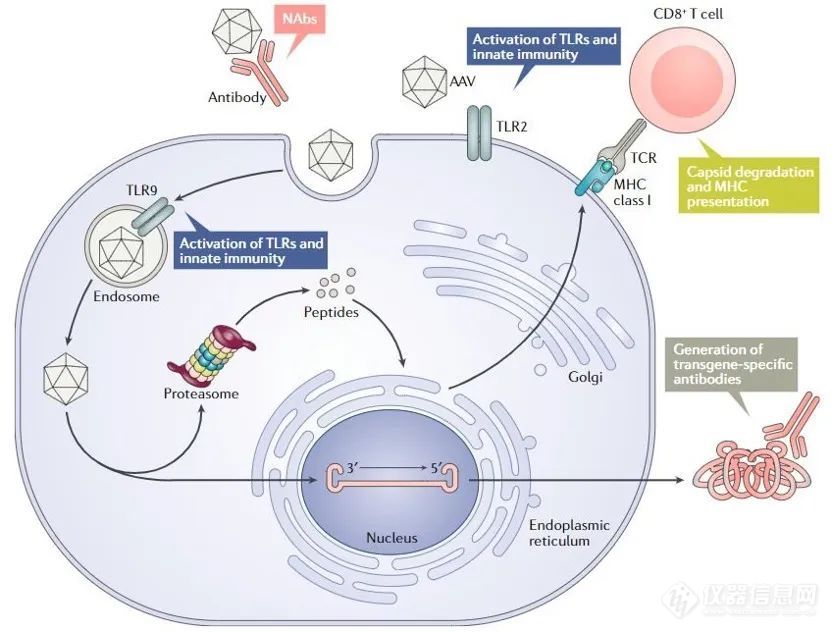
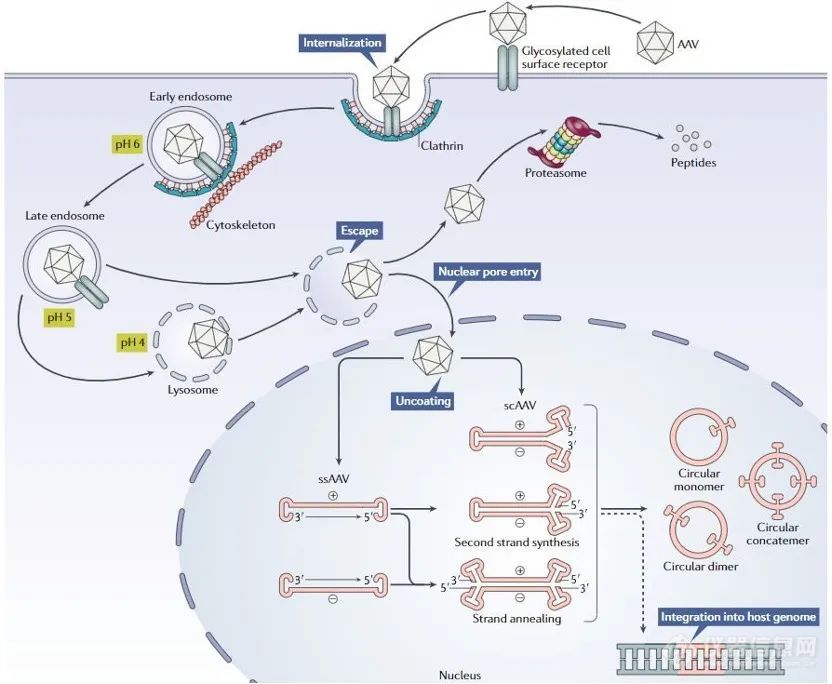
重组AAV颗粒通过与宿主细胞表面表达的糖化受体相结合,通过网格蛋白(clathrin)介导的内吞作用进入细胞◆◆◆★★■。在内吞形成的内体(endosome)酸化之后,病毒衣壳的VP1/VP2部分构象发生变化,导致病毒从内体中脱离◆■■■,并且通过核孔进入细胞核。进入细胞核后,单链DNA从衣壳中释放出来。这时单链DNA还不能进行转录,它们需要变成双链DNA。单链DNA可以利用宿主细胞的DNA聚合酶来 合成互补链◆◆◆★■,或者两条从不同AAV颗粒中释放的互补链退火(annealing)形成双链DNA。
图片来源◆■★★:2019年第37届J.P. Morgan健康大会,Biomarin
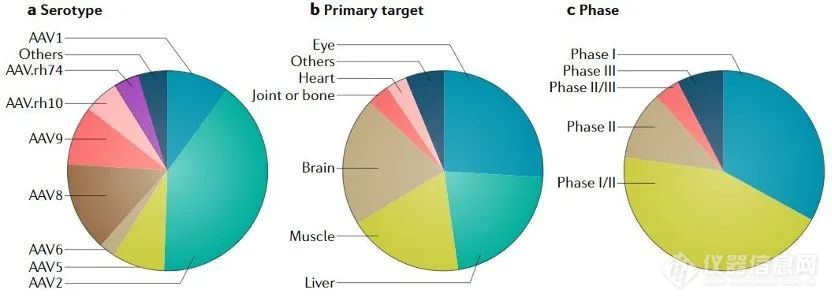
目前已发现12种AAV血清型和100多种突变体★◆,不同血清型的区别在于衣壳蛋白,因此导致不同血清型AAV对各组织或细胞感染效率不同(靶向性)。多数基因疗法的靶向组织是肝脏★◆★■■、横纹肌和中枢神经系统◆★◆★,几乎所有天然AAV能够在肝脏中转染,因此重组AAV为靶向肝脏提供了优良的基因递送平台■★,包括A型和B型血友病■◆◆、家族性高胆固醇血症等疾病。
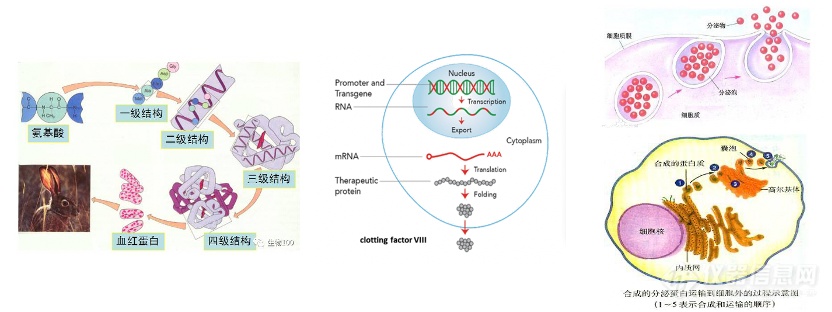
质粒DNA基因治疗:是指基因工程化的★■、能够将治疗性基因导入人类细胞的环形DNA分子。通常是分离/扩增目的基因后将其导入到质粒中,然后转染细菌进行质粒的增殖◆★★◆■★,以生产用于治疗的质粒产品,质粒进入细胞核后可转录出mRNA从而表达目标蛋白。比如2019年3月在日本获批的Collategene,即为搭载肝细胞生长因子 (HGF)的质粒,用于治疗外周动脉闭塞性疾病◆■■◆。
装载容量的问题:AAV载体的容量只有约4.7kb■■,对于很多较大的基因■■,需要选择其截断的有功能的区域★★,如递送凝血八因子FVIII时去除了其B-domain◆★★◆,递送DMD基因时★■,选择了micro-DMD基因。核心解决策略在于优化治疗基因序列的设计◆■■◆。
一如大家所知★◆★★,生命科学的中心法则是所有生命活动遵循的基石,DNA双螺旋结构发现者之一Francis Crick在1958年提出的这一规则为现代分子生物学乃至整个生命科学领域奠定了最坚实的科学基础★◆★◆■◆,也为生物医药领域,特别是近年来愈发明显的新型modality、多学科融合的新型疗法◆■■◆、不断涌现的生物技术新范式提供了底层科学上的指导。
基因治疗(gene therapy)是指将外源正常基因导入靶细胞■◆,以纠正或补偿缺陷和异常基因引起的疾病,进而达到治疗的目的。基因治疗是一种根本性的治疗策略★■,有望从根本上治愈一些现有常规疗法不能解决的疾病。
![]()
现有基因治疗载体的核心话题是基因到达靶细胞的效率,理想状态下只要能把基因递送到指定的细胞上,许多疾病基本可以治疗,但实现起来有诸多困难。比如■◆,肝脏疾病只有40%的传递效率◆■■,眼科疾病20-40%◆◆◆,脑科疾病甚至低于10%(由于血脑屏障)■★◆■◆;

细菌载体基因治疗:通过改造去除细菌(如沙门氏菌)引发传染性疾病的能力但仍然保留其对某些组织(如肿瘤)的亲和性,再将目的基因/寡聚核苷酸导入细菌,给药后即可感染靶细胞并释放基因改造材料。暂无该类药物上市,在研的包括癌基因沉默的产品、提高癌抗原表达的产品。
图片来源:FDA,The promise and challenge of therapeutic genome editing,兴业证券研究所
睿创微纳【车规级红外热成像图像处理芯片】荣获第六届金辑奖“最佳技术实践应用奖”
双链形式的AAV基因组然后利用ITRs进行分子内或分子间基因组重组,这一过程让AAV基因组成为稳定的游离DNA(episomal DNA),导致基因组能够在不再进行有丝分裂的细胞中持续进行基因表达■■◆。
预存免疫(pre-existing anti-AAV antibody):据传染病学统计,40-80%的人体内携带针对AAV的抗体。这可能导致AAV作为基因疗法载体在未递送转基因时就被免疫系统摧毁,降低转基因的表达水平。解决策略包括使用从非人灵长类中分离的AAV衣壳,AAV载体的理性设计与定向进化。
工业化生产(CMC,临床转化)。基因治疗的CMC(关键化学■★■★、制造和控制)不同于传统的化学药◆■◆★◆,在整个IND临床报批、上市后稳定生产供应要求更高,而且有一点非常关键:基因治疗是新兴技术■★,获批上市的产品为数尚少■■★◆,不像传统的小分子与大分子药,没有大范围的可遵循的IND★★◆◆★■、BLA(NDA)◆■◆、CMC固定行业标准★■◆◆,所以企业与监管机构的有效沟通显得格外重要。
“体外■◆■★■◆”基因治疗可分为6个步骤:1)将正常基因插入到病毒载体的DNA上;2)将重组后的病毒DNA体外包装产生具有感染能力的完整工程病毒;3)获取病人的体细胞,如造血干细胞等,体外培养扩增;4)用重组后的病毒感染获取的病人细胞,病毒把正常基因导入靶细胞中;5)对携带正常基因的重组细胞体外 培养扩增;6)将携带正常基因的重组细胞回输到病人体内,实现疾病的治疗。
“第十七届中国在线分析仪器应用及发展国际论坛暨展览会将于11月3-6日在杭州召开(附 大会日程)
3.小分子诱导、转录因子based目标序列表达开关,即带有signal on/off机制的基因治疗;
倚锋资本投资团队遵循这一科学法则,尝试探讨行业发展趋势与其中存在的投资机会。题为★★◆◆■★“生命科学中心法则系列◆■”,本篇为第一期“基因治疗”★★◆■,作为开篇,期待讨论与交流。
第三个要素是基因载体。以AAV为例■★■:复制的起点、包装的信号、末端的序列,AAV的自身天然序列ITR,外壳蛋白的CAP序列;
作为基因疗法载体的重组腺相关病毒(rAAV)携带的蛋白衣壳与野生型AAV几乎完全相同,然而衣壳内的基因组中编码病毒蛋白的部分被删除◆★,取而代之的是治疗性转基因(transgene)。AAV基因组中唯一被保留的部分是ITRs,它起到指导基因组的复制和病毒载体组装的作用■★◆◆。将编码病毒蛋白的部分完全删除的优点是:一方面可以最大化重组AAV携带转基因的容量◆■■◆,另一方面减小体内递送转基因时产生的免疫原性和细胞毒性。

针对蛋白质分泌过程进行优化,增加目标蛋白向血液中的分泌效率(外泌率)、提高目标蛋白的活性; 譬如,如何让肝脏细胞把蛋白快速分泌到血液循环中,真正起到治疗效果■■★◆;如果生产的蛋白不能正确的折叠、不能有效的分泌出细胞膜,而是“憋”在细胞里面■★,就会造成毒性。
血友病是一组遗传性凝血功能障碍的出血性疾病★■,其共同特征是活性凝血活酶生成障碍,凝血时间延长,终生具有出血倾向■◆,重症患者没有明显外伤也可发生持续或自发性出血,特别是在关节◆■◆■★、肌肉或内脏器官中■■■◆◆,长期可导致残疾。2018年5月◆■★,国家卫生健康委员会等5部门联合制定了《第一批罕见病目录》,血友病被收录其中◆★★◆◆■。
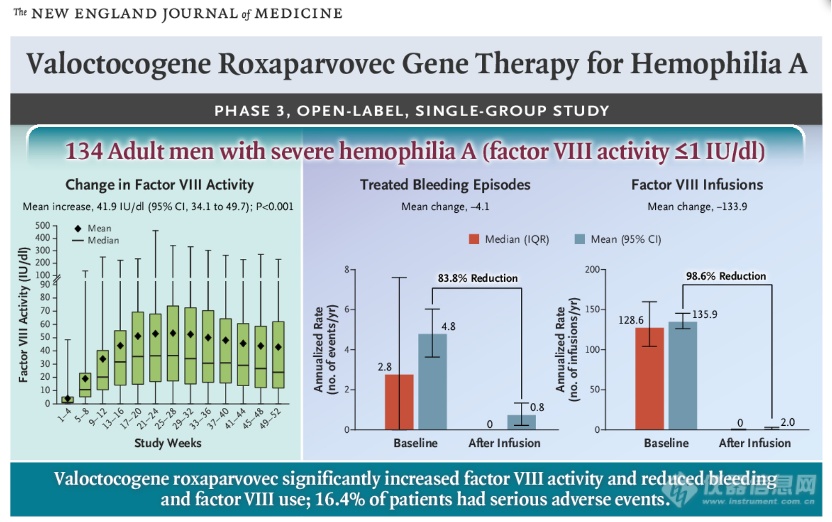
Valoctocogene roxaparvovec是一种使用AAV5载体递送凝血因子VIII基因的体内基因疗法,其优势在于可能只需要一次治疗就能获得表达凝血因子VIII的基因,从而不再需要长期接受凝血因子注射◆■★; 基于这一优势,该基因疗法上市后很可能会让目前的A型血友病产品“如临大敌★■■”,且首先与罗氏的抗体药物Hemliba展开竞争。今年对60名美国血液学家的调查显示,若valoctocogene roxaparvovec顺利获批★★★◆■,预计在一年内将有29%的Hemliba患者和34%的凝血因子VIII患者转为基因治疗。
基因编辑(以CRISPR/Cas9为代表):切割靶基因■■◆◆■,并对其进行精确编辑(删除■◆★★★、插入、替换等),实现对患者基因组“错误”基因的修正,基因编辑可以认为是基因治疗的终极手段,其涉及的治疗过程比基因增补复杂、潜在风险也更大、技术挑战也更高★■★■■★,目前发展阶段不如基因增补成熟★■◆◆◆。
第二个要素是基因表达的系统。病毒的瞬时作用元件◆★■■,首要是启动子,天然抑或是人工改造的启动子,在基因药物的设计中非常重要,不同的启动子;还有在表观遗传学里面,增强子起到至关重要的调控作用■◆■;
其中:对于靶细胞的转染效率与安全性(毒性)直接相关■★★,因为较高的转染效率意味着较低的使用剂量,直接降低了细胞毒性■◆◆,最典型的就是肝毒性。
核酸序列的设计。1)直接影响目标蛋白的表达,以及分泌效率;2)DNA序列决定了蛋白的表达,同时也决定了表达蛋白的二级、三级结构(蛋白的折叠与空间构象★■◆★,是生命科学的最重要线)蛋白的二级与三级结构又直接会影响到从靶细胞(如肝脏细胞)向血液中的分泌能力。这是决定药物剂量的第一个因素。
然而,疾病的发生往往涉及多个基因■★◆■◆★,对应的蛋白质之间的相互作用形成了一个庞大的调控网络,仅对某一个或几个基因进行调节难以达到治疗疾病的目的。
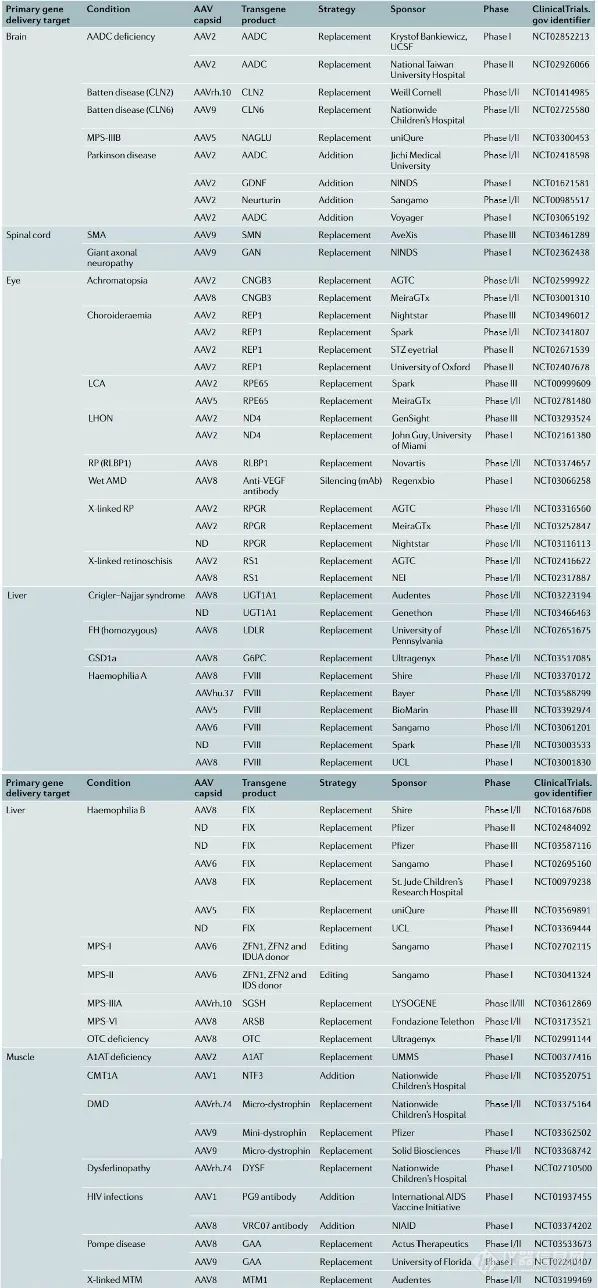
2016-2019年临床以AAV为载体的基因治疗试验数量增长迅猛★■■■★,从不足10个增加到了接近45个; 临床试验中所用最多的是基于AAV2血清型载体,但是新的血清型如AAV8■★★★★■、AAV9、AAV10也在不断被用于临床试验; 以AAV为载体的基因治疗主要靶向眼、肝◆■、肌肉和脑部◆■◆,其中尤以靶向眼部疾病的临床试验数量为多,大多进行I/II期临床试验。
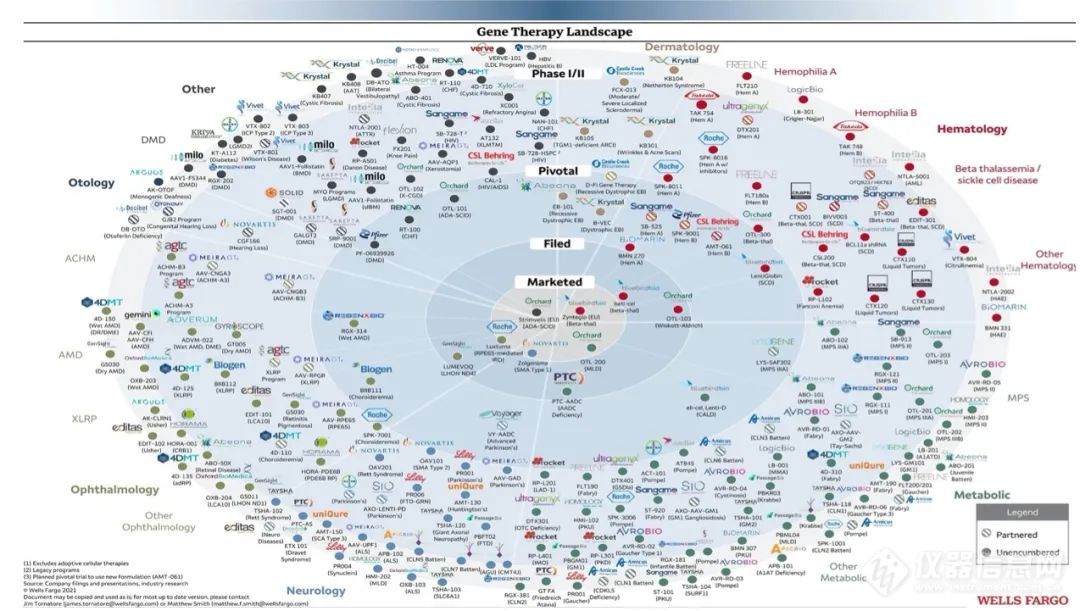
目前对人体基因功能和疾病发生机制的研究仍然非常有限,存在大量未被发现的新基因和信号网络◆■★★。基因和疾病太多的不确定性极大地限制了基因治疗的应用领域,故而基因治疗目前只适用于少数致病机制或治疗方案非常明确的疾病■◆★■,其中以单基因遗传病为代表。
基因治疗的适应症主要包括:眼部疾病、血液疾病、神经退行性疾病以及其它遗传类疾病。目前全球已发现7000多种已确定的罕见病,超过80%的罕见病具有已知的单基因致病机理■★★◆★。从基因治疗MOA的角度而言■★■★◆■,最佳的适应症范围即为单基因致病机理的遗传疾病。

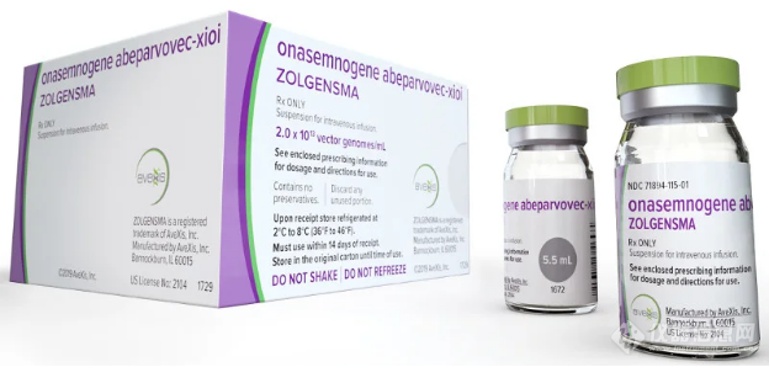
2020年★★★■,日本安斯泰来相继宣布了三位受试者在AT132临床试验中死亡,前两位死于细菌感染和败血症★★,第三位患者死于胃肠道出血。死亡的三位患者均采用3x1014 vg/kg剂量的治疗,并在给药后3~4周内开始出现肝功能异常迹象。由于安全性问题屡发,AT132试验最终被FDA叫停。
AAV是目前发现的一类结构最简单的单链DNA缺陷型病毒,所以无自主复制能力◆★,需要与辅助病毒(腺病毒或疱疹病毒)进行共感染以便复制,需要辅助病毒(通常为腺病毒)参与复制。目前的科学界共识是AAV不会导致任何人类疾病◆■,大多数成年人都感染过AAV病毒,但尚未发现该病毒是任何疾病的致病因素。
中国科学院高端光学显微成像技术联盟成立大会暨光学显微成像技术与应用交流会第一轮通知
细胞治疗和基因治疗并不容易划分清楚,为了更好的概括,有一种方法是将细胞和基因治疗合称细胞和基因治疗(cell and gene therapy,CGT);另外一种是分为广义■◆、狭义的区分,按照技术类别来分,这种方法更容易区分■★◆■◆。
病毒载体:包括腺相关病毒(AAV)、慢病毒(LV)■■★★、腺病毒(AdV)和逆转录病毒(RV)等★◆★◆,相比于腺病毒和逆转录病毒来说■◆■★,腺相关病毒(AAV)与慢病毒载体(LV)安全性较好,两者所占临床试验的比例近年来也在逐步增加,其中AAV载体已经成为基因治疗的首选载体;
细胞治疗是指利用某些具有特定功能的细胞的特性,采用生物工程的方法获取和/或通过体外扩增、特殊培养等处理后,产生的特异性功能强大的细胞,回输体内后■■◆■★,从而达到治疗疾病的目的◆★★◆◆◆。
资料来源◆■◆★★◆:The New England Journal of Medicine
根据给药方式和治疗流程的不同★◆◆■★★,基因治疗可分为“体内◆◆◆★■”治疗和“离体”治疗(体外)两大类:
小分子(以靶向药、小分子抑制剂为代表)、大分子(以单克隆抗体为代表)大多作用在蛋白质层面,基本作用机制是抑制或激活特定蛋白的活性■■■◆■■; 基因治疗从DNA的层面介入★◆,可以从源头上解决疾病的发生■★■。
诺华公司2022年8月11日在一份电子邮件声明中说★★■◆■,两名患儿在输注Zolgensma后(同时在1-10日内接受类固醇逐步递减剂量的治疗以对抗肝脏并发症)的六周死于急性肝脏衰竭★◆◆◆■,死亡事件分别 发生在俄罗斯和哈萨克斯坦,具体原因仍在调查中◆★◆■。
第一个要素是致病基因★★。比如DMD,序列改造很重要,将改造后的序列装进容量有限的AAV里面做成药,是几乎所有基因治疗产品都要面对的首要核心话题◆◆★◆■;又譬如血友病A★◆◆,删除B Domain◆■◆◆◆◆,如何保留序列、如何引入外源序列、增强分泌,亦是一个核心的science话题■■★■◆。所以,在第一个层面上的设计,将会很大程度上影响后续的研发与推进★★■;
![]()
图片来源:The source, harvesting procedure, culture and several potential uses of stem cells,兴业证券研究所
2020年12月■■◆★★★,2020年12月,美国食品药品监督局FDA审查了对ASPIRO试验方案的修改后,允许临床试验再开,并且将剂量降低到1■★★.3×1014 vg/kg剂量水平。2021年9月1日,安斯泰来宣布其基因疗法AT132针对X连锁肌管性肌病(XLMTM)患者的临床试验中,一位患者在肝脏检查时发现了严重的不良反应,随即宣布了暂停临床试验。而就在该位患者暂停用药的两周后,9月14日该患者去世了◆■★■◆。这是第四位在安斯泰来AT132临床试验中去世的受试者。
新生儿SMA的发病率在1/6000-1/10000◆■■■◆◆,按照我国每年1500万的新生人口计算◆★■★,国内的I型SMA患者约在1200-2000人。该药售价为212★◆◆★.5万美元◆★◆■■■,一度是史上最昂贵药物。目前已经在多达37个国家获批★■■,治疗了超过800例患儿。诺华年报显示,Zolgensma在2020、2021年及2022年上半年的销售收入分别为9.2亿美元、13.51亿美元及7.42亿美元★■■★。
生命科学的中心法则■★■■★◆:在生物体内,遗传信息沿着“DNA-RNA-蛋白质”的方向逐级传递★◆★◆■,蛋白质是遗传信息的表现形式,亦是一切有机生命体的表现形式,因此疾病发生时多表现为蛋白质层面的异常;
第四个要素是基因导入系统。转入到特定的组织细胞里面,AAV不同血清型★★◆■、突变型、人工改造型,决定了基因药物的有效性■■、副作用;优化AAV的设计■■★■◆,使其具备更好的组织靶向性■★■■、器官靶向性◆★,将会有效的降低剂量、降低毒副作用;
倚锋资本投资团队遵循这一科学法则,尝试探讨行业发展趋势与其中存在的投资机会■★。题为“生命科学中心法则系列”★★◆,本篇为第一期“基因治疗★★■■”,作为开篇★■★■★★,期待讨论与交流。
第五个要素是在临床用药的实施。不同的给药方式★★■★,如静脉、肌肉◆★、鞘内注射、玻璃体/脉络膜上腔注射的具体选择■◆■,对于不同的产品、患者群体、以及不同的适应症,是一个非常重要的课题★◆■★◆,Zolgensma在国外是静脉注射,在国内报批的临床是鞘内注射(2022年6月开启,北大一院儿科熊晖教授)。
一如既往案例,肝脏毒性一直困扰着基因治疗,监管机构曾警告称Zolgensma可能会导致严重的、 潜在的致命性肝脏并发症★■★★。诺华公司表示◆★★,这是Zolgensma首次发生患者因急性肝衰竭而死亡的事件★◆■■★。公司将更新药物的标签,明确说明Zolgensma副作用已导致死亡■★■◆◆■。
2020年8月FDA拒绝了Biomarin的上市申请BLA★◆★,该申请基于3期临床研究的中期分析数据■■,以及来自1/2期研究的三年数据★◆◆★■,FDA对BioMarin正在进行的3期临床研究270-301中的两年数据提出了新的建议,要求以年均出血率(ABR) 为主要终点,FDA建议BioMarin完成3期临床研究★◆◆,并提交所有研究参与者的两年随访安全性和有效性数据; 2021年5月公布积极结果,Biomarin公布了给药后五年和四年随访■■★■★,年均出血率减少95%,安全性数据良好◆■; 2021年6月28日,BioMarin宣布重新向EMA提交在研血友病A基因疗法valoctocogene roxaparvovec的上市许可申请 (MAA),批准决定时间预计为2022年上半年。2022年6月◆◆■★,又再一次宣布延期至9月。
Copyright © 2012-2018 贝斯特游戏网站网址,贝斯特全球最奢游戏官网,贝斯特老虎机官网318网站 版权所有
电 话:0898-08980898 手 机:13877778888 传 真:0000-0000-00 E-mail:admin@Your website.com
地 址:广东省清远市

扫码关注我们